 UFSCar UFSCar
7 de Abril de 2021
Cerca de 300 milhões de pessoas em todo o mundo sofrem com doenças causadas por diferentes tipos de fungos, e mais de dois milhões morrem por ano, especialmente nos países mais pobres. As estimativas são do Fundo de Ação Global para Ações Fúngicas (GAFFI), que afirma ser possível salvar mais de um milhão dessas vidas com avanços em diagnóstico, tratamento e monitoramento de infecções e da resistência às drogas existentes. Mesmo assim, infecções fúngicas são negligenciadas e o assunto é pouco abordado, principalmente quando comparamos com a atenção dada a bactérias e vírus.
Na UFSCar, Iran Malavazi, docente do Departamento de Genética e Evolução (DGE), coordena grupo de pesquisa que busca compreender diferentes espécies de fungos patogênicos - ou seja, que oferecem riscos à saúde humana -, para produzir conhecimento aplicável ao desenvolvimento de novos fármacos. Ele explica que a semelhança entre fungos e humanos é um dos desafios nesta busca.
"Há uma falsa impressão de que os fungos são plantas, talvez por alguns deles, como os cogumelos, crescerem no solo. Mas eles têm a mesma linhagem evolutiva dos animais, não parecem e muito menos são plantas", esclarece Malavazi. "Isto faz com que o nosso genoma e o dos fungos sejam muito parecidos. Quanto mais parecidos patógeno e hospedeiro, mais difícil é a terapêutica, porque os alvos das drogas empregadas são compartilhados entre eles", explica. Ou seja, o que poderia atacar o invasor faz mal também às células humanas, resultando em efeitos colaterais importantes.
Outro problema é que, assim como bactérias e vírus, fungos também se tornam resistentes aos fármacos utilizados e, hoje, não são muitas as opções terapêuticas existentes. Malavazi conta que ainda hoje são usados medicamentos introduzidos no mercado na década de 1950, e que a última das quatro classes de drogas antifúngicas usadas foi introduzida na clínica médica em 2002.
Doenças
Não são todos os fungos que causam problemas. Alguns, inclusive, são muito importantes na vida humana, como aqueles usados na fermentação e, assim, produção de alimentos e bebidas; os cogumelos comestíveis; e as espécies com aplicações biotecnológicas, como a penicilina e muitas outras. Alguns, no entanto, não só causam doenças graves nos seres humanos, mas também afetam plantas, destruindo cerca de um terço da colheita de alimentos anualmente (em lavouras de trigo, arroz, milho, soja, batata e outras) e impactando a biodiversidade vegetal e, também, animal, com doenças, por exemplo, em anfíbios, morcegos e abelhas.
Dentre os fungos patogênicos humanos, quatro são os gêneros mais comuns: Candida, Aspergillus, Cryptococcus e Pneumocystis.
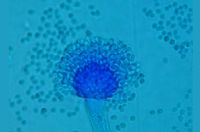
Os fungos estão por toda parte, no solo, no ar, e não há como evitá-los. No caso de fungos filamentosos (comumente reconhecidos como mofos ou bolores), como o Aspergillus fumigatus estudado pelo pesquisador da UFSCar, cada pessoa inala centenas de esporos (conídios) desses fungos por dia. No entanto, na maior parte dos casos, o risco atinge apenas quem apresenta algum comprometimento na resposta imune, como pacientes em tratamento de câncer, transplantados ou com HIV.
Como o número de pessoas que apresentam quadro de imunossupressão vem aumentando mundialmente, em paralelo ocorre o aumento das infeções de natureza fúngica. Durante a pandemia, também tem sido identificada associação frequente entre casos graves de Covid-19, com necessidade de internação, e infecções por Aspergillus fumigatus. Em parte significativa desses casos, a infecção secundária, ou seja, pelo fungo, é a responsável pela morte do paciente, apontam estudos.
O gênero Aspergillus tem cerca de 200 espécies, das quais 20 colonizam órgãos humanos, mas o Aspergillus fumigatus é responsável por mais de 90% dos casos de aspergilose pulmonar invasiva, a forma mais grave da doença, que mata de 60 a 90% dos pacientes acometidos.
Defesa e ataque
"Eu trabalho sempre do ponto de vista do microrganismo. É necessário conhecer o microrganismo para atacá-lo. Outros cientistas se dedicam à compreensão de como o hospedeiro reage à infecção. Eu me interesso por como o fungo 'sente' o ambiente onde está, como diferencia o solo, de onde precisa sair, e as vias aéreas - onde geralmente a infecção é combatida - ou o pulmão do hospedeiro, que ele coloniza no caso das pessoas imunocomprometidas. Que adaptações ele precisa fazer?", situa Iran Malavazi ao falar sobre o seu trabalho.
Uma das hipóteses é que os chamados metabólitos secundários sejam uma dessas ferramentas que o fungo utiliza na adaptação aos ambientes. Metabólitos primários dizem respeito ao conjunto de reações bioquímicas primariamente relacionadas à obtenção de energia pelas células. Já os metabólitos secundários são moléculas cuja produção demanda dos organismos grande gasto energético e que têm entre as suas funções, em geral, justamente a adaptação ou algum ganho que permita ao organismo melhor persistência no seu nicho.
Malavazi exemplifica com o caso da penicilina, um metabólito secundário produzido por fungos para se defender de bactérias. "Não é uma vida fácil! Fungos, bactérias, amebas, no ambiente, estão no mesmo solo e, nesse nicho ecológico, é preciso se defender. Os metabólitos secundários são as armas que precisam ser usadas e, muitas vezes, essas moléculas são importantes também no momento da infecção do hospedeiro", explica o pesquisador da UFSCar, contando, por exemplo, que vários metabólitos secundários são imunossupressores, ou seja, comprometem a resposta imune dos hospedeiros. Aliás, um dos principais fármacos usados como imunossupressor na prevenção da rejeição em transplantes de órgãos e no tratamento de doenças autoimunes, a ciclosporina, é também um metabólito secundário produzido por outra espécie de fungo.
Junto com colaboradores, o docente da UFSCar acaba de publicar no periódico Genetics - referência na área de Genética e Biologia Molecular - os resultados de estudo sobre o papel de metabólitos secundários produzidos pelo Aspergillus fumigatus. O trabalho iniciou-se a partir dos estudos conduzidos durante a tese de doutorado de Marina Campos Rocha, então estudante no Programa de Pós-Graduação em Genética e Evolução (PPGGEv) da UFSCar e hoje pesquisadora de pós-doutorado no laboratório de Malavazi.
A molécula estudada foi a fumiquinazolina C, com função ainda desconhecida. Além de terem encontrado evidências dos processos genéticos que fazem com que ela exista apenas nos conídios, a pesquisa identificou que altas quantidades de fumiquinazolina inibem a fagocitose, um mecanismo que pode ser importante tanto no solo quanto na invasão ao corpo humano.
"Amebas de vida livre existentes no solo são um modelo de estudo importante pois sobrevivem fagocitando possíveis 'concorrentes' de modo análogo ao que fazem os nossos macrófagos na resposta imune inata do nosso corpo", revela Malavazi. Ou seja, a hipótese é que a fumiquinazolina, uma molécula antifagocítica, que permite aos fungos se defender das amebas antes da infecção do hospedeiro, no solo, poderia ajudar também a sua evasão das nossas células de defesa. "No entanto, a segunda parte, da infecção, ainda demanda mais estudo, já que o sistema no organismo humano é muito mais complexo, com outras células atuando, além dos macrófagos, mediadores químicos e outras variáveis", registra o pesquisador. "Porém, o fato da fumiquinazolina C integrar o grupo seleto de metabólitos secundários presentes nos conídios, que são a parte do fungo que inalamos e pode gerar a colonização de órgãos como o pulmão, sugere também a sua importância nessa estrutura de propagação do fungo", complementa.
O artigo, intitulado "Transcriptional control of the production of Aspergillus fumigatus conidia-borne secondary metabolite fumiquinazoline C important for phagocytosis protection" pode ser conferido através deste link. Além de Malavazi, assinam o trabalho outros integrantes do Laboratório de Bioquímica e Genética Aplicada (LBGA) da UFSCar e parceiros da Universidade de São Paulo (USP), Universidade Estadual de Campinas (Unicamp), Universidade Estadual Paulista (Unesp), Universidade Federal do ABC (UFABC) e do Leibniz Institute for Natural Product Research and Infection Biology-Hans Knöll Institute, Jena (Alemanha).
|